近日,万众瞩目的武汉病毒所石正丽竟然又火了。其实,就在前两天,印度有几个生物学者,突然宣布在此次疫情病毒序列中,找到了4个艾滋病毒片段,这种结构变化可能也增加了2019-nCoV可以感染的宿主细胞范围。
而天然病毒的变异过程中,无法产生这样的RNA变异跃迁。况且在之前的研究过程中,第一时间已经获知此次的武汉肺炎2019-nCOV病毒原宿主是蝙蝠,根本没有任何关于HIV的信息来源。
于是这篇论文的潜台词就是2019-nCOV是由人工干预合成,将矛头直指这几天正因为双黄连乌龙而处在风暴中心的武汉病毒研究所及旗下国内首屈一指的P4病毒实验室。

但很快,在武汉病毒所石正丽教授的强烈质疑和反对之下,这几位印度学者就撤下了这篇论文,而石正丽教授也发表了一篇朋友圈,用自己的性命做担保,此次病毒和实验室没有任何关联。
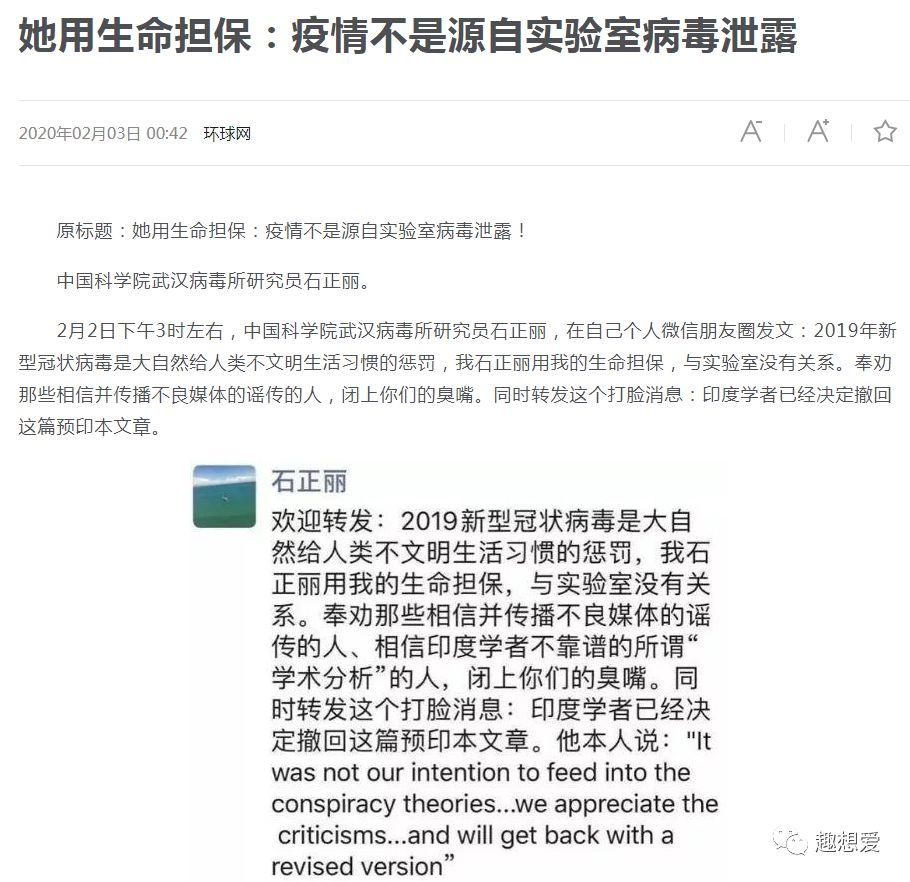
以上信息可以从各大媒体公开的信息来源获知。
但我的疑问不在于印度学者对于病毒的研究结论,而是作为一个生物科学家,石正丽教授应该用论文、实验、数据等一系列的研究结果去反对和抗议那些“阿三”的奇思妙想。
但从这个事件整体来看,反倒是印度学者这边的论文有头有尾,有数据有图表有结论。我们石教授只是以一句“我可以用生命做担保…”

科学还停留在打赌以及搏命的年代么?是打算学布鲁诺那样因为坚持哥白尼学说而赌上自己的性命?
我天生比较好奇,于是我就去世界知名的自然科学网站寻找了关于石正丽教授前几年的几篇论文,插个序(从论文质量和数量以及引用因子来看,石教授的科研水平和能力要远远高过这几天同样风头浪尖上的武汉病毒研究所“美女”王所长~~)

言归正传,2015年,著名的自然医学电子刊物上发表了一篇论文,主要作者为中国科学院武汉病毒学研究所、武汉大学病毒研究所教授石正丽。
这篇论文说,他们医学研究发现,只要把蝙蝠身上的S蛋白里的ACE2这个受体开关一调,这个病毒马上就可以传染给人类。利用病毒基因重组技术将蝙蝠的S蛋白和小老鼠的Sars病毒重组,得到的新病毒可以和人体的血管紧张素转化酶2(ACE2)结合,能很有效地感染人类的呼吸道细胞,毒性巨大。
他们发现新病毒明显地损害了老鼠的肺部,所有疫苗管失去作用。于是,石正丽团队继续用猴子做实验,模拟病毒在人体上的效果。
以下是石正丽及团队发表的关于改造蝙蝠沙士病毒研究文章的链接。(写于2015年)
https://www.nature.com/articles/nm.3985?fbclid=IwAR0iTTfDlT-uxNFPtvQH-xFrF6QaF1hKE1Ey2TPrEi17XfFUElbpUlAosDc
中间有几个非常有意思的点,我截取下来,一起来看看;

“我们构建了一种嵌合病毒,编码了一种新型的、人畜共患病的病毒蛋白——取自从中国蝙蝠中分离出的RsSHC014-CoV序列1——在SARS-CoV小鼠适应型骨干的上下文中。
杂交病毒使我们能够评估新型尖峰蛋白在自然主干中独立于其他必要的适应性突变而导致疾病的能力。利用这种方法,我们以SHC014峰蛋白在原发性人体气道细胞和体内的CoV感染为特征,并测试了现有免疫疗法对SHC014-CoV的疗效。
该策略共同翻译了基因组学数据,以帮助预测和准备未来的突发病毒。”
这一段原文和翻译应该都能看明白,武汉病毒所石正丽教授的团队,的确是在构建了一种嵌合病毒,通过编码产生一种新型的,可以同时感染人畜患病的病毒蛋白。
我们接着往下看;

“SARS样嵌合病毒的构建。
如前所述,野生型和嵌合病毒均来自SARS-CoV Urbani或相应的小鼠适应性(SARS-CoV MA15)感染性克隆(ic)27。
通过限制性消化提取含有SHC014刺突序列的质粒,并连接到MA15感染性克隆的E和F质粒中。设计该克隆,并使用侧接独特的II类限制性核酸内切酶位点(BglI)的已公开序列,从Bio Basic购买六种连续cDNA。之后,扩增,切除,连接和纯化含有野生型,嵌合SARS-CoV和SHC014-CoV基因组片段的质粒。
然后进行体外转录反应以合成全长基因组RNA,如先前所述将其转染到Vero E6细胞中2。收获转染细胞的培养基,并用作后续实验的种子库。
在用于这些研究之前,通过序列分析证实了嵌合和全长病毒。嵌合突变体和全长SHC014-CoV的合成构建得到北卡罗来纳大学机构生物安全委员会和关注双重用途研究委员会的批准。”
这段原文中专业术语相当多,我直接用Google进行翻译,大致上可以让大家看清楚,石正丽教授在论文中所讲述的通过提取SHC014刺突序列(病毒感染的关键因子)链接到原有病毒上并且克隆产生新版变种病毒的构建过程。
无独有偶,在石正丽教授2015年发布了上述改编病毒基因序列从而产生更易传播导致人畜患病的新病毒之后,这个实验就引起美国医学界非常大的争议。
医学专家Declan Butler也在Nature Medicine上撰文表示,这种实验没有什么意义,而且风险很大。

由于缺乏技术,当时石正丽团队是和美国北卡罗莱纳的一个医学小组合作。而在早一年也就是2014年美国疾病控制中心意识到这个病毒有可能成为生物化学武器时,立刻已经叫停了这种病毒改造计划,并停止拨款给相关的研究。
我们同样再来看看医学专家Declan Butler在Nature Medicine上的论文;
原文如下:
“一项创建蝙蝠冠状病毒(与导致SARS(严重急性呼吸道综合症)的病毒有关的病毒)的混合版本的实验引发了关于可能的大流行性病毒的工程实验室变种是否值得承担这一风险的重新辩论。
在11月9日《自然医学》(Nature Medicine )上发表的一篇文章中,科学家研究了一种名为SHC014的病毒,该病毒在中国的马蹄蝠中发现。
研究人员创造了一种由SHC014的表面蛋白和SARS病毒的骨架组成的嵌合病毒,SARS病毒的骨架已经适应于在小鼠中生长并模仿人类疾病。嵌合体感染了人类气道细胞-证明SHC014的表面蛋白具有与细胞上的关键受体结合并感染它们的必要结构。它也引起小鼠疾病,但没有杀死它们。”
这里原文和翻译都标明了新型病毒是“嵌合体感染了人类气道细胞-证明SHC014的表面蛋白具有与细胞上的关键受体结合并感染它们的必要结构”。
接着往下看;
The findings reinforce suspicions that bat coronaviruses capable of directly infecting humans (rather than first needing to evolve in an intermediate animal host) may be more common than previously thought, the researchers say.
But other virologists question whether the information gleaned from the experiment justifies the potential risk. Although the extent of any risk is difficult to assess, Simon Wain-Hobson, a virologist at the Pasteur Institute in Paris, points out that the researchers have created a novel virus that “grows remarkably well” in human cells. “If the virus escaped, nobody could predict the trajectory,” he says.
研究人员说,这一发现加剧了人们的怀疑,即能够直接感染人类的蝙蝠冠状病毒(而不是首先需要在中间动物宿主中进化)更普遍。
但是其他病毒学家质疑从实验中收集的信息是否可以证明潜在的风险。尽管很难评估任何风险的程度,但巴黎巴斯德研究所的病毒学家西蒙·韦恩·霍布森(Simon Wain-Hobson)指出,研究人员创造了一种新型病毒,该病毒在人细胞中“生长良好”。
他说:“如果病毒逃脱了,没有人能够预测其发展轨迹。”
还有这一段:
But Wain-Hobson disapproves of the study because, he says, it provides little benefit, and reveals little about the risk that the wild SHC014 virus in bats poses to humans.
Other experiments in the study show that the virus in wild bats would need to evolve to pose any threat to humans — a change that may never happen, although it cannot be ruled out. Baric and his team reconstructed the wild virus from its genome sequence and found that it grew poorly in human cell cultures and caused no significant disease in mice.
“The only impact of this work is the creation, in a lab, of a new, non-natural risk,” agrees Richard Ebright, a molecular biologist and biodefence expert at Rutgers University in Piscataway, New Jersey. Both Ebright and Wain-Hobson are long-standing critics of gain-of-function research.
研究中的其他实验表明,野蝙蝠中的病毒需要进化以对人类构成任何威胁-尽管不能排除,但这种变化可能永远不会发生。
Baric和他的团队从其基因组序列重建了野生病毒,发现该病毒在人类细胞培养物中生长缓慢,并且在小鼠中未引起任何重大疾病。
“这项工作的唯一影响是在实验室中创造了一种新的非自然风险,”新泽西州皮斯卡塔韦的罗格斯大学分子生物学家和生物防御专家理查德·埃布赖特(Richard Ebright)表示同意。Ebright和Wain-Hobson都是对功能获得研究的长期批评家。
也就说石正丽教授这一轮从蝙蝠身上获取的病毒原株,再到通过人工合成使其更易攻击人体呼吸细胞的新型变种,其实在2015年就已经被项目合作方,美国北卡罗莱纳的一个医学小组叫停了,理由是风险远大于实际实验成果。
那我还记得在2020年1月初,大量媒体在报道关于石正丽教授发现SARS原宿主蝙蝠以及在研究SARS病毒上孜孜不倦花上15年时间。
那这个研究成果,以及项目进度或者项目最终的结局,导向哪里?可能99%以上的人,都被蒙在鼓里了。

今天还有一个消息,在微博上上了热搜,排名第二的是:“【中国首席生化武器防御专家陈薇少将参与武汉战疫】”,对于这个武汉病毒所石正丽有何解释呢。

